Lucian Beer, Sebastian Röhrich

Lucian Beer
Die Detektion und Abklärung von Lungenrundherden ist eine häufige Fragestellung in der täglichen Praxis. Dementsprechend widmeten sich mehrere Sessions am diesjährigen ECR dieser Thematik. Die dominierenden Diskussionspunkte waren dabei (1) das Management von Rundherden bei Patientinnen und Patienten ohne oder mit maligner Vorerkrankung, (2) das Staging und Restaging von Patientinnen und Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) und (3) die neo-adjuvante Chemo-Immuncheckpoint Inhibitor Therapie.
Entscheidend bei der Diagnose von pulmonalen Rundherden ist, ob es sich um Menschen mit einer malignen (Vor-) Erkrankung handelt. Beim Fehlen einer malignen (Vor-) Erkrankung mit einem oder multiplen Rundherden gibt es mehrere Guidelines, welche für die Risikostratifizierung verwendet werden können und konkrete Handlungsempfehlungen liefern. Die am weitesten verbreiteten Empfehlungen sind die Fleischer Guidelines, welche für solide und subsolide Rundherde (teilsolide Rundherde oder reine Milchglasrundherde) anwendbar sind. Die Differenzierung zwischen soliden und subsoliden Rundherden ist insbesondere wichtig, da subsolide Rundherde ein längeres Follow-up benötigen, um eine Malignität ausschließen zu können. Maligne Milchglasrundherde sind typisch für Adenokarzinome, die langsame Wachstumsraten mit Tumorverdopplungszeiten von bis zu 4 Jahren zeigen, weshalb die Kontrollen bis zu 5 Jahre lang durchgeführt werden sollen. Im Gegensatz dazu zeigen solide Tumore deutlich kürzere Tumorverdopplungszeiten, weshalb bereits bei einer Größenkonstanz über 2 Jahre die Kontrolle beendet werden kann.

Sebastian Röhrich
Bei Patientinnen und Patienten mit maligner (Vor-) Erkrankung gibt es im Gegensatz dazu keine etablierten Leitlinien bzgl. des Managements von neu diagnostizierten Rundherden. Als Deskriptoren werden Größe, Größendynamik, Form und Berandung des Rundherds verwendet, um eine Risikostratifizierung durchzuführen. Die Trennschärfe dieser Bildcharakteristika ist jedoch nicht gut untersucht und es kann keine allgemeine Management-Empfehlung dafür abgeleitet werden.
Liegt ein bekanntes Lungenkarzinom vor, sollte das Staging anhand der TNM 8 Klassifikation durchgeführt werden. Die CT-Thorax-Abdomen stellt hierbei die Basis-Untersuchungsmodalität dar. Alle potenziell kurativ behandelbaren Patienten (Stadium I-III) sollten entsprechend der ESMO-Guidelines eine 18F-FDG PET-CT sowie eine MRT mit Kontrastmittel des Neurokraniums erhalten. Dies wird aufgrund der klar erhöhten Sensitivität und Spezifizität im Vergleich zur Schädel-CT empfohlen.

Primäres Lungenkarzinomstaging mittels Kontrastmittel CT und MRT eines neurologisch asymptomatischen Patienten. Die Hirnstammmetastase links ist nur in der MRT erkennbar.
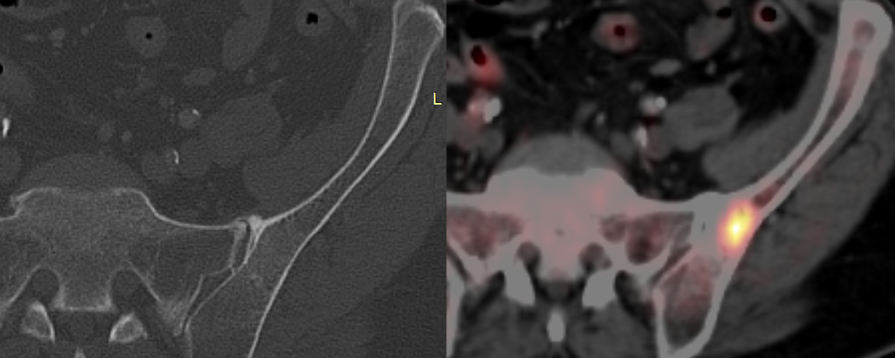
Primäres Lungenkarzinomstaging. Die 18F-FDG PET zeigt eine metabolisch aktive Metastase im linken Ilium, welche im CT nicht erkennbar ist.

Primäres Lungenkarzinomstaging. Die 18F-FDG PET zeigt eine metabolisch aktive Metastase in der linken Nebenniere, welche im CT kaum erkennbar ist.
Die potentiellen Pitfalls beim Lungenkarzinom-Staging sind mannigfaltig und betreffen neben der Differenzierung maligner vs. nicht-maligner Läsionen zunehmend auch die Abklärung synchroner (sekundärer) Lungenkarzinome. Synchrone Lungenkarzinome entstehen unabhängig voneinander und unterscheiden sich genetisch und ggf. histopathologisch. Die Unterscheidung zwischen synchronem Tumor und Metastase ist klinisch relevant, da sie eine kurative oder palliative therapeutische Herangehensweise bedingen kann. Bildgebend hinweisend für das Vorliegen eines synchronen Lungenkarzinoms sind:
- das Fehlen von Lymphknotenmetastasen und Fernmetastasen,
- eine unterschiedliche Morphologie der Rundherde (spikuliert vs. lobuliert),
- eine unterschiedliche Dichte (Milchglas vs. solide),
- eine unterschiedliche Wachstumsrate,
- eine unterschiedliche metabolische Aktivität.

Radiologische Unterscheidungshilfen zur Differenzierung eines synchronen Lungenkarzinoms von intrapulmonalen Metastasen
In diesen Fällen sollte an die Möglichkeit eines synchronen Lungenkarzinoms gedacht und entsprechend im multidisziplinären Team diskutiert werden. Eine Diagnosesicherung kann – sofern technisch möglich – jedoch nur histologisch oder molekulargenetisch gestellt werden. Auch hier gilt der Leitsatz der TNM-Klassifikation welcher besagt, dass im Zweifelsfall das niedrigere Tumorstadium zu verwenden ist, um eine kurative Therapie zu ermöglichen.

Synchrones Lungenkarzinom. In diesem Patienten erkennt man zumindest drei Milchglasrundherde im linken Oberlappen welche im 6 Monat-Verlauf größenprogredient sind und histologisch gesicherten Adenokarzinomen entsprechen.
Ein zweiter Pitfall beim Lungenkarzinom-Staging besteht bei der Zuordnung der korrekten Lymphknotenstation, welche anhand der IASLC Klassifikation erfolgen soll. Für die tägliche Routine ist es hilfreich die IASLC Maps (z.b. https://radiologyassistant.nl/chest/lung-cancer/tnm-classification-8th-edition#n-staging-regional-lymph-node-classification-system) zu verwenden, da mehrere Studien gezeigt haben, dass die korrekte Zuordnung schwierig und die Übereinstimmung gering ist. In Zukunft (TNM 9) könnte die Bestimmung der betroffenen Lymphknotenstationen noch weiter an Bedeutung (aber auch Komplexität) gewinnen, da zwischen singulären und multiplen Stationen für die N-Bestimmung unterschieden werden wird.
Die Einführung der neo-adjuvanten Chemo-Immuncheckpoint Inhibitor Therapie stellt einen Paradigmenwechsel in der Behandlung früher Lungenkarzinome dar. Die Zulassung dieser Therapie wird für Mitte 2023 in Europa erwartet. Sie besteht aus einer Kombination von 3 bis 4 Zyklen klassischer Platin-basierter Chemotherapie 3-Gaben eines Immuncheckpoint Inhibitors. Die Zulassungsstudien zeigten bei bis zu einem Drittel der Teilnehmenden ein komplettes histopathologisches Tumoransprechen – d.h. es sind keine vitalen Tumorzellen mehr im Primärtumor als auch in den resezierten Lymphknotenmetastasen nachweisbar. Patientinnen und Patienten erhalten nach dem Ende des dritten Chemotherapiezyklus eine Verlaufskontrolle (CT oder 18F-FDG PET-CT). Folgende Fragestellungen sollten hier von uns beantwortet werden: 1) Liegt ein morphologisches oder metabolisches Tumoransprechen vor, 2) gibt es neue Läsionen, 3) gibt es therapieassoziierte Komplikationen.
Das radiologische Therapieansprechen (Tumorgröße) korreliert nur schwach mit dem histopathologischen Ansprechen. Grund dafür ist die therapieassoziierte Inflammation und Fibrose, welche das Tumorgewebe ersetzt, jedoch CT morphologisch nicht vom vitalen Tumorgewebe zu differenzieren ist. Die metabolische Aktivität im 18F-FDG PET ist hier ein besserer Parameter, um das Therapieansprechen korrekt zu klassifizieren. Die Rückbildung eines pathologischen FDG-Uptakes entspricht einem kompletten histopathologischen Tumoransprechens.

Patientin mit NSCLC im linken Unterlappen und Chemo-Immuntherapie. Nach 3 Zyklen / Gaben Therapie zeigt sich ein gutes morphologisches und metabolisches (18F-FDG-PET) Therapieansprechen des Tumors (Partial Response). In der nachfolgenden Operation finden sich im Tumorgewebe >50% vitale Tumorzellen entsprechend einem „non-major pathologic response“.
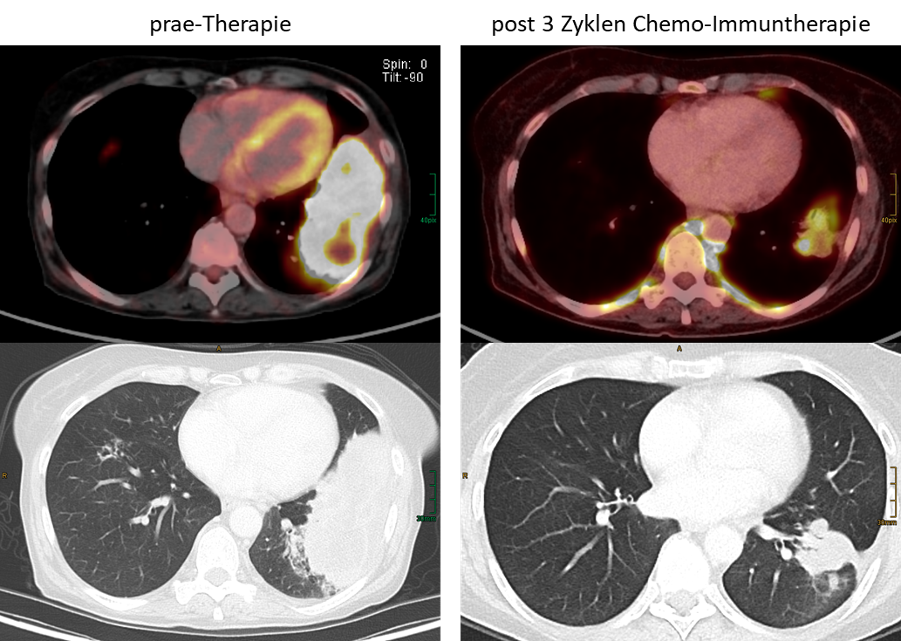
Patient mit NSCLC im linken Unterlappen und Chemo-Immuntherapie. Nach 3 Zyklen / Gaben Therapie zeigt sich ein gutes morphologisches und metabolisches (18F-FDG-PET) Therapieansprechen des Tumors (Partial Response) mit noch deutlichem Tumor-Rest. In der nachfolgenden Operation finden sich im Tumorgewebe >1% vitale Tumorzellen entsprechend einem „major pathologic response“.
Die therapieassoziierte Immunaktivierung kann in einzelnen Fällen auch dazu führen, dass insbesondere mediastinale Lymphknoten an Größe und metabolischer Aktivität zunehmen. Dieses Phänomen wird als „nodal immune flare“ beschrieben. Weder CT noch 18F-FDG PET können zwischen „nodal immune flare“ und Lymphknotenmetastasierung unterscheiden. Bei einem Ansprechen des Primärtumors ist jedoch ein „nodal immune flare“ wahrscheinlicher.
Therapieassozierte Komplikationen sind v.a. die Pneumonitis, welche im neo-adjuvanten Setting selten ist (< 5 %) und sich radiologisch mannigfaltig manifestieren kann (meist Milchglas und Konsolidierungen).
Zusammenfassung:
Die Radiologie hat einen großen Stellenwert bei der Diagnose, Risikostratifizierung und beim Therapiemonitoring des Lungenkarzinoms. Die Risikostratifizierung pulmonaler Rundherde bei Patientinnen und Patienten ohne maligne Vorerkrankung erfolgt anhand Guidelines wie den Fleischner Empfehlungen. Bei Patientinnen und Patienten mit maligner Vorerkrankungen fehlen evidenzbasierte Empfehlungen und die Risikostratifizierung basiert bildgebend meist auf Größe, Größendynamik, Form und Berandung des Rundherds. Im Setting des Lungenkarzinoms sollte beim Vorliegen multipler, morphologisch unterschiedlicher Rundherde an das Vorliegen eines synchronen Lungenkarzinoms gedacht werden. Die Einführung der neo-adjuvanten Chemo-Immuncheckpoint Inhibitor Therapie stellt einen Paradigmenwechsel der Behandlung früher Lungenkarzinome dar und das Wissen über mögliche Therapieansprechmuster erleichtert die Bildinterpretation.
Die verwendete Literatur ist über den Autor beziehbar.
Dr. Lucian Beer studierte zwischen 2008 und 2014 Humanmedizin an der Medizinischen Universität Wien. Parallel zum Medizinstudium begann er 2012 das MD-PhD Studium im Bereich Vascular Biology, welches er 2015 abschloss. Zwischen Oktober 2014 und März 2015 war er als Turnusarzt im Landeskrankenhaus Hollabrunn tätig. Anschließend begann er an der Universitätsklinik für Radiologie und Nuklearmedizin der Medizinischen Universität Wien seine Facharztausbildung. Nach einem 2 jährigen Post-Doc Forschungsaufenthalt der der Cambridge University (UK) schloss er 2022 seine Facharztausbildung ab und ist seitdem als Facharzt für Radiologie an der Medizinischen Universität Wien beschäftigt. Seine wissenschaftlichen Interessen liegen im Bereich der translationalen regenerationsmedizinischen Forschung, hepatobiliären und onkologischen Bildgebung, zu welcher er sich auch im Jahr 2021 habilitierte (Titel: „Quantitative and qualitative multimodality oncologic imaging techniques“).
Dr. Beer ist verheiratet und Vater einer Tochter.

